111弁当箱法では、炭水化物率を総エネルギー量の50-60%(%E)に設定できることも大きなメリットになっています。以前(2024年4月)に掲載した第7回目のブログで、適切な炭水化物率について記載しましたが、その後も、少しずつ新しい情報が蓄積されていますので、現時点でのエビデンスをアップデートしたいと思います。(2025年6月2日記載)
炭水化物率(量)の推奨状況
現在の炭水化物摂取率(量)について、まず、現在の推奨状況について確認してみましょう。日本人の食事摂取基準(2025年版)では、炭水化物摂取率の目標値は総摂取エネルギー量の50-65%(%E)となっています。ちなみに、米国の食事摂取基準では45-65%Eです(1)。炭水化物管理が必要な糖尿病患者においては、糖尿病専門医研修ガイドブック(2023年版)(2)にて50-60%E、糖尿病治療ガイド2024(3)では患者の身体活動、依存疾患、年齢などに応じて、柔軟に個別対応するとして40-60%Eとしています。111弁当箱法の炭水化物率(50-60%E)はこれら全ての食事摂取基準を満たしています。それでは、これら炭水化物摂取基準にはどのような根拠があるのでしょうか。
低炭水化物食、適度な炭水化物食、高炭水化物食の定義
そもそも、諸外国における炭水化物摂取率(量)は、食習慣や地域性、民族性を反映して、41~62%Eと大きな幅があるため(4)、低炭水化物食や高炭水化物食の捉え方が各国、各研究者によって違っているようです。そのためか、低炭水化物食や高炭水化物食の定義は必ずしも一致せず、極端な例を言えば、高炭水化物食を「70%E以上」と定義する研究者もいれば、「45%E以上」と定義されていることもあるため、研究報告の解釈に誤解と混乱が生じることがあります。このため、炭水化物に関する研究報告を評価する場合には、少なくともその定義を一致させて考える必要があります。
低炭水化物食や高炭水化物食の定義が一貫していない問題点を指摘したレビュー(5)によって、その定義が提案されています。多くの研究で採用され、日本の食事摂取基準と照らしても理解しやすいので紹介します(表1)。
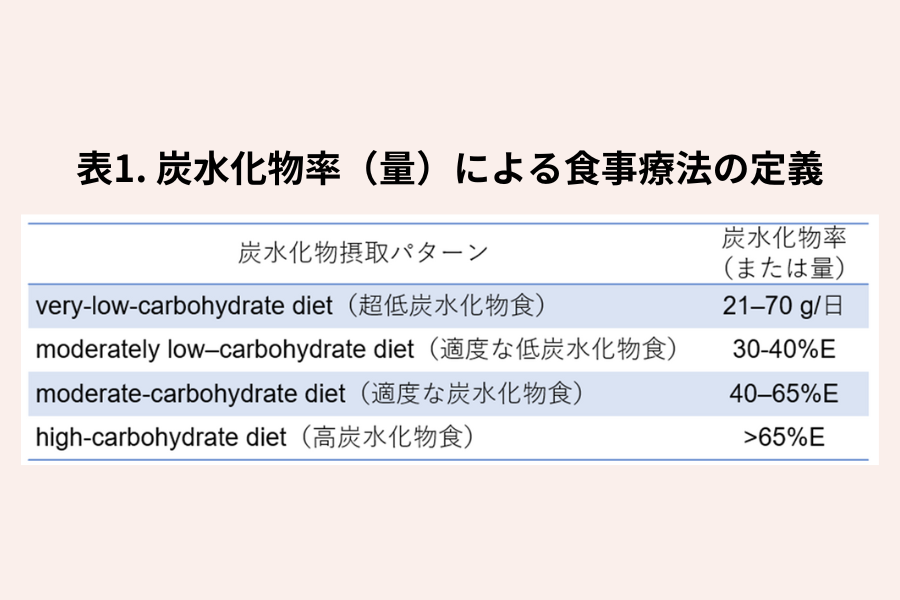
通常の状態では、赤血球と人間の脳の神経細胞は、エネルギー源としてブドウ糖のみに依存しており、1歳から始まるライフステージ全体における炭水化物の必要量は、脳でのブドウ糖の最小必要量から導かれ、適切な炭水化物の摂取量は、エネルギー配分で言えば45~65%、量で言えば130g/日以上とされています(1)。これらを基に、炭水化物40%E未満あるいは130g/日未満を低炭水化物食、65%E以上を高炭水化物食と定義することが多いようです。
生体では、食事からの糖質の供給が減ると、血中へのブドウ糖の主要な供給源は、肝臓での糖新生に置き換わります。飢餓と低炭水化物食で生じる血糖値の低下により、インスリン分泌の低下とグルカゴンやカテコールアミンといったインスリン拮抗ホルモンの増加が引き起こされ、肝臓での糖新生が亢進するのと同時に、骨格筋での蛋白質分解が進んで、糖新生に必要な材料の一つであるアミノ酸の供給も増加します。更に、高度な糖質制限と飢餓状態が長期にわたると、脂肪組織等に蓄えられた中性脂肪の分解も亢進し、多量の遊離脂肪酸(FFA)が血中に放出され、肝臓に運ばれたFFAからケトン体が産生されます。FFAやケトン体は末梢組織における代替エネルギー源として使われ、特にケトン体は、脳ではブドウ糖に代わる唯一の代替エネルギー源となります。アトキンス食やケトジェニック食のような超低炭水化物食は、高度のケトン体産生を特徴としており、それを惹起する炭水化物制限量に基づいて定義されていると言えます。
適正な炭水化物摂取量に関するエビデンス
炭水化物摂取量に関するレビューは多くの人が書いているので、ここでは、代表的なエビデンスと最近新しく追加された研究報告をまとめます。
1)低炭水化物食・一般集団でのメリットとデメリット
超低炭水化物食は、炭水化物食品にだけ注目した単純・簡単なダイエット法で、従来のエネルギー制限を基にしたダイエット法よりも大きな減量効果があることが示されています(6, 7, 8)。しかし、その減量の機序は、食事の単調さと単純さによって食欲と食物摂取量が減り、単に摂取カロリーが少ないだけであると考えられており(9)、エネルギー制限以外の代謝上の利点は否定されています(10, 11)。一方、そのデメリットとして、単調で過酷な食事制限のために1年以上の継続が難しく(12, 13)、高齢者ではサルコペニアに繋がる可能性(14)や、逆にメタボリック症候群になりやすいこと(15)等が報告されています。
死亡リスクとの関係についても、米国の政策的疫学研究であるARIC研究およびそれに付随するメタ解析から、炭水化物摂取量が50〜55%Eで最も死亡リスクが低く、それより多くても少なくても死亡リスクが高くなることが示されており(16)、長期的な安全性の問題が指摘されています。日本の多施設共同コホート研究(J-MICC研究)でも、男性の低炭水化物食と女性の高炭水化物食で死亡リスクが高いことが示され(17)、ほぼ同様の結果が得られています。
2)低炭水化物食・糖尿病患者でのメリットとデメリット
2型糖尿病の血糖管理との関係については、多くの系統的レビューやメタ解析があり、それらの結果から、日本糖尿病学会は、糖尿病診療ガイドライン2024(18)の中で、「2型糖尿病の血糖コントロールのために、6~12ヵ月以内の短期間であれば炭水化物制限は有効である」と弱い推奨でのステートメントを出しています。しかし、総エネルギー量を制限せずに、炭水化物のみを極端に制限すること(超低炭水化物食)については、効果や安全性を担保する科学的根拠が不足しているとのことで、現時点では勧められていません。
2型糖尿病患者の死亡リスクとの関係については、大規模コホート研究の結果が報告されています(19)。炭水化物量の多寡によって対象者を5つのグループ(五分位)に分け、炭水化物摂取が最も多いグループ(第1五分位:平均炭水化物率59.5%E)と比べ、最も少ないグループ(第5五分位:38.7%E)は全死亡リスクが最も低くなることが示されています。ただし、その中間の第3五分位のグループ(推定50%E前後)でも既に有意なリスク低下があり、「適度な炭水化物食」でも死亡リスクは低いと考えられます。また、食事の質について、一般集団で示されているのと同様に、炭水化物を減らした時の代替栄養素として、植物性脂肪/タンパク質を摂取しているグループでは死亡リスク低減効果がより強調され、動物性脂質/タンパク質を摂取するグループでは死亡リスク低減効果が消失し、逆に死亡リスクが増加することが示されています(19)。ここで問題になるのが、2型糖尿病患者では、一般集団とは違い、低炭水化物食が死亡リスクを増加させないのかという疑問です。残念ながら、それを検討できる研究が殆ど無いことや、上記の研究でも、40%E未満の低炭水化物食を行っていた患者数が非常に少ないため、中等度~高度の低炭水化物食が本当に2型糖尿病患者の死亡リスクを増加させないのかについては、現時点では不明です。
1型糖尿病における低炭水化物食の特別な懸念は低血糖とケトアシドーシスのリスクに関するものであり、一般的な懸念には心血管系のリスク、栄養素の欠乏、小児の成長不良などが含まれます。1型糖尿病患者において、低炭水化物食が血糖コントロールに及ぼす影響を検討した信頼できる研究は非常に少なく、エビデンスは不足しています。近年、適度な低炭水化物食が1型糖尿病患者の血糖管理に対して有効かつ安全であることが多施設共同無作為化クロスオーバー試験で示されていますが(20)、短期間(低炭水化物食期間は4週間)での検討であり、有効性と安全性に関する情報は不足したままです。1型糖尿病に対する低炭水化物食の有効性と安全性に関するエビデンスは乏しく、ケトアシドーシスや重症低血糖のリスクが高まる可能性があるため、1型糖尿病患者に対して低炭水化物食は推奨されていません(18)。
3)高炭水化物食・一般集団/糖尿病患者でのデメリット
包括的レビューにて、高炭水化物食は、体重増加、異所性脂肪沈着、心血管疾患のリクス増加と関連することが示されています(21)。
死亡リスクとの関係では、多国籍コホート研究 (PURE cohort study)(22)や米国の政策的疫学研究であるARIC研究、およびそれらのメタ解析から、高炭水化物食(60%E以上)で死亡リスクが増加することが示されています (16)。日本の多施設共同コホート研究であるJ-MICC研究(17)やNINIPPON DATA 80(23)からも、女性の高炭水化物食グループは死亡リスクが高いことが示されています。
2型糖尿病患者でも、炭水化物摂取量が多い程、死亡リスクが高くなることが示されています(19)。
まとめ
以上より、炭水化物摂取と健康状態への影響についてまとめると、
- 一般集団と糖尿病患者のいずれにおいても、炭水化物率60%E以上の高炭水化物食は避けるべき
- 一般集団においては、短期的な体重減少効果として超低炭水化物食にメリットがあるが、死亡リスクの増加と、サルコペニアやメタボリック症候群の発症リスク等のデメリットを考慮すると、長期的な超低炭水化物食の実施は避けるべき
- 一般集団において、リスクが最も低いのは炭水化物率50-55%Eの「適度な炭水化物食」であり、その中でエネルギー摂取量の適正化が勧められる
- 2型糖尿病では、炭水化物率30-40%Eあるいは70-130g/日の「適度な低炭水化物食」が、血糖管理や死亡リスクの低減に寄与する可能性はあるが、現時点では6~12ヵ月以内の短期間にとどめるべき
- 2型糖尿病では、一般集団で死亡リスクが最も低い炭水化物率50-55%Eを参考に、40-60%Eの範囲で個別に対応することが勧められる
- 1型糖尿病については、低炭水化物食の有効性と安全性についてのエビデンスは不足しており、現時点では、従来通り40–60%Eの「適度な炭水化物食」の範囲内で個別に対応するのが妥当
となります。
これらのことから、111弁当箱法の炭水化物率50-60%Eは、多くの人にメリットのある炭水化物率と考えられます。
参考文献
1. Heymsfield SB, et al. Guidance on Energy and Macronutrients across the Life Span. N Engl J Med. 2024;390(14):1299-310.
2. 日本糖尿病学会. 糖尿病専門医研修ガイドブック改訂第9版. 東京: 診断と治療社; 2023.
3. 日本糖尿病学会. 糖尿病治療ガイド2024. 東京: 文光堂; 2024.
4. 藤谷朝実. 糖質制限はどこまで必要か. 日本調理科学会誌. 2020;53(5):365-7.
5. Wheeler ML, et al.Macronutrients, food groups, and eating patterns in the management of diabetes: a systematic review of the literature, 2010. Diabetes Care. 2012;35(2):434-45.
6. Gardner CD, et al.Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study: a randomized trial. Jama. 2007;297(9):969-77.
7. Shai I, et al.Weight loss with a low-carbohydrate, Mediterranean, or low-fat diet. N Engl J Med. 2008;359(3):229-41.
8. Hashimoto Y, et al.Impact of low-carbohydrate diet on body composition: meta-analysis of randomized controlled studies. Obes Rev. 2016;17(6):499-509.
9. Astrup A, et al. Atkins and other low-carbohydrate diets: hoax or an effective tool for weight loss? Lancet. 2004;364(9437):897-9.
10. Johnston BC, et al.Comparison of weight loss among named diet programs in overweight and obese adults: a meta-analysis. Jama. 2014;312(9):923-33.
11. Hall KD. A review of the carbohydrate-insulin model of obesity. Eur J Clin Nutr. 2017;71(3):323-6.
12. Naude CE, et al. Low carbohydrate versus isoenergetic balanced diets for reducing weight and cardiovascular risk: a systematic review and meta-analysis. PLoS One. 2014;9(7):e100652.
13. Nordmann AJ, et al.Effects of low-carbohydrate vs low-fat diets on weight loss and cardiovascular risk factors: a meta-analysis of randomized controlled trials. Arch Intern Med. 2006;166(3):285-93.
14. Hall KD, et al.Calorie for Calorie, Dietary Fat Restriction Results in More Body Fat Loss than Carbohydrate Restriction in People with Obesity. Cell Metab. 2015;22(3):427-36.
15. Dustin D, et al.Carbohydrate Intakes Below Recommendations With a High Intake of Fat Are Associated With Higher Prevalence of Metabolic Syndrome. J Acad Nutr Diet. 2023;123(7):1022-32.e13.
16. Seidelmann SB, et al.Dietary carbohydrate intake and mortality: a prospective cohort study and meta-analysis. Lancet Public Health. 2018;3(9):e419-e28.
17. Tamura T, et al.Dietary Carbohydrate and Fat Intakes and Risk of Mortality in the Japanese Population: the Japan Multi-Institutional Collaborative Cohort Study. J Nutr. 2023;153(8):2352-68.
18. 日本糖尿病学会. 糖尿病診療ガイドライン2024. 東京: 南江堂; 2024.
19. Hu Y, et al.Low-Carbohydrate Diet Scores and Mortality Among Adults With Incident Type 2 Diabetes. Diabetes Care. 2023;46(4):874-84.
20. Sterner Isaksson S, et al.The effect of carbohydrate intake on glycaemic control in individuals with type 1 diabetes: a randomised, open-label, crossover trial. Lancet Reg Health Eur. 2024;37:100799.
21. Huang Y, et al.Dietary sugar consumption and health: umbrella review. Bmj. 2023;381:e071609.
22. Dehghan M, et al.Associations of fats and carbohydrate intake with cardiovascular disease and mortality in 18 countries from five continents (PURE): a prospective cohort study. Lancet. 2017;390(10107):2050-62.
23. Nakamura Y, et al.Low-carbohydrate diets and cardiovascular and total mortality in Japanese: a 29-year follow-up of NIPPON DATA80. Br J Nutr. 2014;112(6):916-24.



コメント