肥満のある人は食行動の制御が早期から破綻しており、それが過食につながっています。また、減量を試みる人は、一時的に減量が成功したとしても、その多くはリバウンドをきたして元の体重にもどってしまいます。今回は、リバウンドのメカニズムと、そこにポーションコントロールがどのように関与しうるのかについて説明したいと思います。(2025年7月1日投稿)
(第8回目の「過食のメカニズム」も参照して下さい)
リバウンドのメカニズム
生体には恒常性を保つ機能(恒常性調節機構)があり、通常の体重では、エネルギーの摂取量と消費量は連動し、一定の体重(エネルギー貯蔵量)を維持するように変動調整されています。そのため、特に体重が減少するようなエネルギーバランスの変化が生じても、エネルギー摂取と消費を調節するシステムに変化が生じ、いずれ元の体重に戻ります (1)。もしエネルギーの摂取と消費が連動していなければ、エネルギー摂取を160kcal/日(ご飯1膳分)減らす、あるいはエネルギー消費を160kcal/日(ジョギング20分)増すだけで、一定のペースで体重は減り続け、1年間に8.1kg減少(体脂肪組織の80%が脂質として)することになりますが、現実にはそのようなことは起こりません。通常、肥満者が減量を試みても、最初の約6ヵ月間は体重が減少し、その後、短期間(3~6ヵ月間)体重が停滞した後、最終的に体重が元に戻るという経過をたどることが良く知られています (1)。減量中および減量後では、エネルギー摂取量とエネルギー消費量が間接的に連動して変化し、エネルギー消費量の減少と食欲の増加の両方が起こるため、どうしようもなく体重が元に戻ってしまうのです。
すなわち、ダイエットで一時的に減量に成功しても、その体重を維持するには、低下したエネルギー消費率を更なる身体活動の増加で補うか、増強する食欲に何らかの対策を講じる必要があります。しかも、それらに要する努力の程度は、自然に同じ体重になった人に要求されるレベルを超えたものであり、減量後も数年以上持続すると考えられています (1)。これが、80%以上というリバウンド率の高さ (2)の原因になっています。
摂食行動の調節
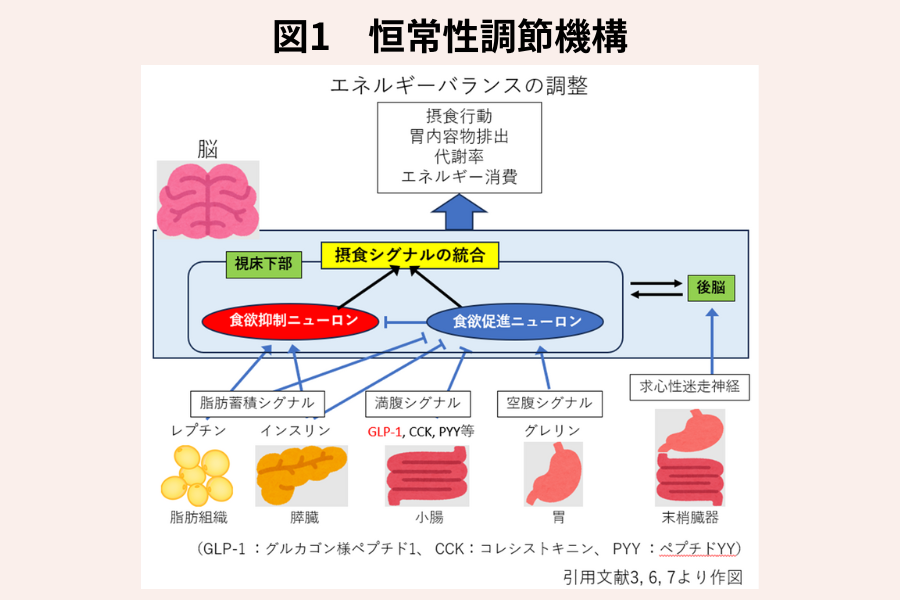
恒常性調節機構では、図1に示すように視床下部に食欲の抑制と促進を担うそれぞれのニューロンが存在し、脂肪細胞由来のホルモンであるレプチンがエネルギーの蓄積状態を視床下部に伝達し、食事に関連して膵臓から分泌されるインスリン、消化管由来のグルカゴン様ペプチド1(GLP-1)、コレシストキニン(CCK)、ペプチドYY(PYY)、グレリン等によるシグナルや、胃や腸といった臓器から後脳に伝わった求心性迷走神経シグナルとともに視床下部で統合され、摂食行動や胃内容物の排出、代謝率、エネルギー消費等を調節して、エネルギー貯蓄状態(体重)の恒常性を保ちます (3)。減量後では、この恒常性調節機構が仇となり、リバウンドが生じることになります。また、これらのシグナルを調節するGPL-1受容体作動薬やGLP-1/GIP受容体作動薬が、糖尿病治療薬や抗肥満薬として、臨床応用されています。
肥満者では、慢性的な高脂肪食や飽和脂肪酸の増加によって引き起こされた視床下部の炎症反応や、神経細胞の活性化の変化等によって、レプチンやインスリン等のシグナルが伝わり難くなっており、恒常性調節機構による摂食抑制が早期から破綻していると考えられています (4)。これが、肥満者において、更なる過食や減量後のリバウンドが生じやすくなる原因となっています。
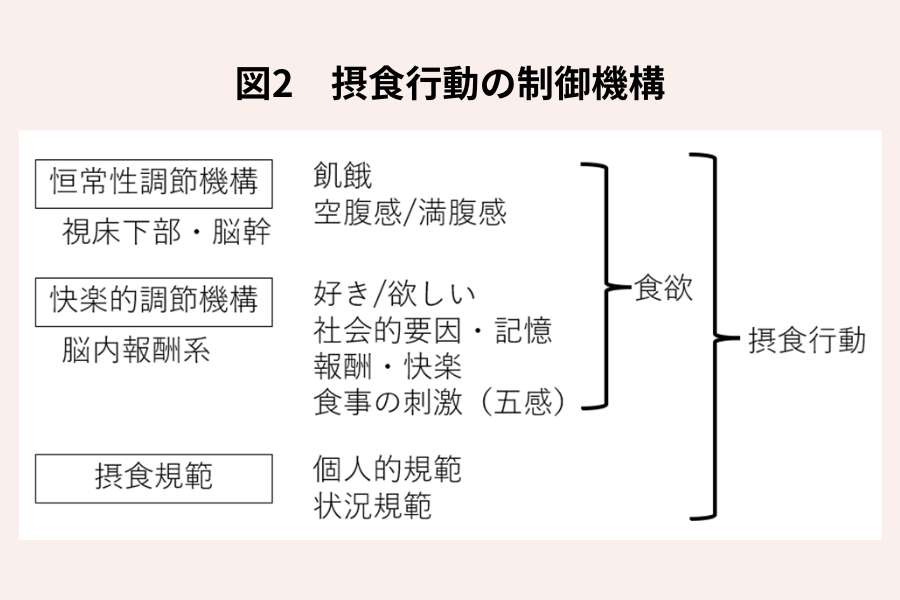
食欲に基づく摂食行動は、恒常性調節に加え、快楽的調節によっても影響をうけます(図2)。快楽的調節では、食事摂取は食事の刺激(美味しさや香り等)や、社会的要因、情動、記憶によって影響を受け、恒常性維持の必要性を超えて嗜好性の高い食品の摂取を促しますので、過食の切掛けになることがあります。恒常性調節とは、飢餓のような生体のエネルギー状態に応じた摂食調節であり、快楽的調節は、美味しい物を食べた時に幸福感を感じるように、脳の報酬系機構が中心的な役割を担った摂食調節です。この2つの脳内調節系は相互に影響を及ぼし、共同して食欲に基づく摂食行動を制御していると考えられています。
更に、人では、これら食欲による調節機構以外に、摂食規範が摂食行動に強く影響を及ぼすことも知られています(図2)。この摂食規範は学習、強化、修正できることから、破綻した食欲による摂食調節を補う手段の1つとして期待されます。近年、食欲の制御に関し(図1)、2型糖尿病に対する血糖降下薬として使用されるGLP-1受容体作動薬の一部(セマグルチド(ウゴービ®)、チルゼパチド(ゼップバウンド®))が、「肥満症」*に対しても保険適用となり、有効な抗肥満薬として使用されていますが、GLP-1受容体作動薬の中止後には食欲増強とそれによるリバウンドが生じるため、そういった治療を受けている人であっても、むしろ、その治療中に摂食規範を強化しておく必要があります。
摂食規範とポーションコントロール
食事摂取の規範的コントロールは、食べ過ぎを避けたいという動機に基づくものです。ダイエットを行う人は、多かれ少なかれ自分自身に制限的な摂食規範を課していますが、しばしばその規範に違反しています。この摂食規範には「個人的規範」と「状況規範」があります。「個人的規範」は、ある状況下でどれくらいの量を食べるのが適切かを判断するために、個人的に決めたルールです。「状況規範」は、食事の状況そのものから導かれるもので、例えば、ポーションサイズや社会的影響などがあり、これらは摂取量に強力な影響を及ぼすことが知られています (5)。
肥満者では生理的コントロール(満腹感)が破綻して信頼できないため、摂食規範がなければ、いつ食べるのをやめればいいのかわからなくなります。また、本物の満腹感が感じられる頃には、もう手遅れ(食べ過ぎている)だということは誰もが経験があると思います。それを制御する手がかりが摂食規範です。「状況規範」は、食事の状況そのものから推測される適切さの規範をいい、不適切に大量に食べることなく食べられる量を推測する手がかりを与えてくれます。食事状況の代表例として、「ポーションサイズ(1人前)」があります。レストラン等で料理が出されると、その分量が「食べるべき最適量」であると疑い無く受け入れ、本当は自分にとって多くても少なくても、提供された分のみを食べ終えてしまうことがそれにあたります。第二の例として「社会的影響」があります。親しくない同伴者の前や高級レストランで食事する際に、おかわりをすると節操のない食べ過ぎと思われるため、おかわりをしないことが多いですが、食べ放題のビュッフェではおかわりをすること自体が通常行為であるため、食べ過ぎてしまうといった状況を生み出します。
こういった摂食規範の内、状況規範であるポーションサイズを用いて、その最適量を提示、あるいは学習させる食事療法(ポーションコントロール)が古くより行われており、それを実践するために世界中で多くのポーションコントロールツールが使われています。
注釈
「肥満症」*は、BMI 25以上の肥満があり、かつ肥満に起因ないし関連する健康障害(合併症)を1つ以上有するか、あるいは内臓脂肪蓄積がある場合など関連健康障害の合併が予測され、医学的に減量を必要とする病態と定義される慢性疾患であり、単に「脂肪組織に脂肪が過剰に蓄積した状態で、BMI 25以上のもの」と定義される「肥満」とは違うことに注意が必要です。
参考文献
1. Rosenbaum M. Appetite, Energy Expenditure, and the Regulation of Energy Balance. Gastroenterol Clin North Am. 2023;52(2):311-22.
2. Adeola OL, Agudosi GM, Akueme NT, Okobi OE, Akinyemi FB, Ononiwu UO, et al.The Effectiveness of Nutritional Strategies in the Treatment and Management of Obesity: A Systematic Review. Cureus. 2023;15(9):e45518.
3. Badman MK, Flier JS. The gut and energy balance: visceral allies in the obesity wars. Science. 2005;307(5717):1909-14.
4. Sasaki T. Age-Associated Weight Gain, Leptin, and SIRT1: A Possible Role for Hypothalamic SIRT1 in the Prevention of Weight Gain and Aging through Modulation of Leptin Sensitivity. Front Endocrinol (Lausanne). 2015;6:109.
5. Herman CP, Polivy J. Normative influences on food intake. Physiol Behav. 2005;86(5):762-72.
6. Panduro A, Rivera-Iñiguez I, Sepulveda-Villegas M, Roman S. Genes, emotions and gut microbiota: The next frontier for the gastroenterologist. World J Gastroenterol. 2017;23(17):3030-42.
7. Clarke GS, Page AJ, Eldeghaidy S. The gut-brain axis in appetite, satiety, food intake, and eating behavior: Insights from animal models and human studies. Pharmacol Res Perspect. 2024;12(5):e70027.



コメント